芳基氟化反應
簡介
芳基含氟砌塊是指一系列擁有一個或幾個直接連接到芳環骨架上的氟原子的芳香族化合物。當氟引入芳烴時,可以提供許多優異的特性。首先,氟化芳烴比非氟化芳烴親脂性更強,這可以在藥物開發中得到利用,提高藥物分子的脂溶性,可增強含氟藥物分子在生物體內對膜、組織的穿透能力,從而提高生物體內的吸收和傳輸速度。此外,在藥物化學中,氟有時被用作氫的電子等排體(氫和氟的空間參數相似,范德華半徑分別為1.2 ?和1.35 ?)。除此之外,含氟化合物還可以戰略性地被用作過渡態抑制劑。

圖1.芳基含氟砌塊
由于氟自身特殊的性質,無論采用什么方法,任何生成C-F鍵的反應都是一個重大的挑戰。氟化物陰離子,由于其電負性和小的離子半徑(1.33 ?),可以與各種氫鍵供體如水、醇、胺和酰胺形成強氫鍵。氟離子在水介質中的高溶解性會導致其周圍有一個緊密結合的水分子水合層。因此,在有氫鍵供體的情況下,氟化物通常只有微弱的親核性,而氟化物的這種弱親核性限制了通過親核取代反應生成C-F鍵。
芳烴氟化方法
傳統的親核芳烴氟化反應
關于傳統親核芳烴氟化反應的一個主要挑戰是對相對簡單的底物的限制,這是由苛刻的反應條件和親核氟化物的強毒性造成的。1927年,Balz和Schiemann通過伯芳香胺通過四氟硼酸重氮中間體經過熱分解轉化為芳基氟化物[1,2],開辟了芳烴的親核氟化反應(圖2)。
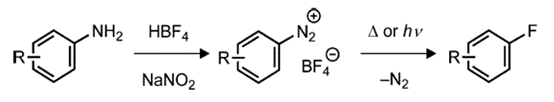
圖2.芳基重氮鹽的親核氟化
該反應在概念上類似于Sandmeyer反應,將重氮鹽轉化為其他芳基鹵化物(ArCl、ArBr)[3]。然而,盡管Sandmeyer反應涉及銅試劑/催化劑和自由基中間體,但四氟硼酸重氮的熱分解在沒有助催化劑的情況下進行,生成高度不穩定的芳基陽離子(Ar+),從而提取來自BF4?的F?,得到氟芳烴(ArF)以及作為副產物的三氟化硼。
親核氟化反應
親核氟化是一種簡單而有效的芳烴親核氟化的方法,排除了水和其他會減弱氟化物親核性的氫鍵供體。四丁基氟化銨(TBAF)是一種商業易得,易溶于有機溶劑的親核試劑,可作為三水合物使用(圖3)。
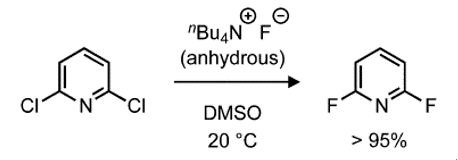
圖3.使用TBAF的親核芳烴氟化
酚類的親核脫氧氟化
除了芳基鹵化物,苯酚是合成芳基氟化物更易反應且更易獲得的底物。例如,鄰苯二酚可以先進行脫氧氟化,然后用硼氫化鈉還原(圖4)。
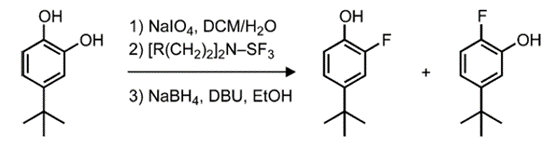
圖4.通過一鍋反應對鄰苯二酚進行脫氧氟化
親電氟化反應:
與上述芳基氟化互補的方法是使用芳基親核試劑和親電氟化試劑。N-F氟化試劑在形式上可以作為氟離子的來源,常用的親電氟化試劑如圖5所示。
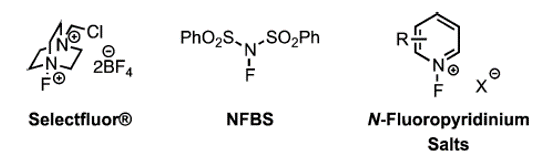
圖5.常用的親電氟化試劑
其中,Selectfluor(N-氟-N'-(氯甲基)三乙二胺雙(四氟硼酸鹽)或F-TEDA)是一種用戶友好、溫和、空氣和水分穩定、非揮發性的親電氟化試劑。Selectfluor試劑能夠在一個步驟內將氟引入有機底物,同時具有非常廣泛的反應性[4]。此外,這些反應均表現出良好的區域選擇性。
使用Selectfluor氟化試劑完成了一種強效和無細胞毒性的丙型肝炎病毒RNA復制核苷抑制劑的合成(圖6)。與母體2'-C-甲基腺苷相比,這種核糖苷顯示出明顯的酶學穩定性[5]。

圖6.使用Selectfluor的親電氟化試劑
應用
芳基含氟砌塊被廣泛用作合成藥物的中間體或藥物分子,其中氟取代可以通過影響pKa、調節構象、疏水相互作用和親脂性或這些屬性的疊加來提高藥效和對靶標的選擇性。除此之外,芳基含氟砌塊還可以應用于殺蟲劑、塑料和與液晶技術有關的分子中。
參考文獻
1.Balz, Günther; Schiemann, Günther (1927). "über aromatische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung" [Aromatic fluorine compounds. I. A new method for their preparation.]. Chemische Berichte (in German). 60 (5): 1186–1190. https://doi.org/10.1002/cber.19270600539
2.Furuya, Takeru; Klein, Johannes E. M. N.; Ritter, Tobias (2010). "C–F Bond Formation for the Synthesis of Aryl Fluorides". Synthesis. 2010 (11): 1804–1821. https://doi.org/10.1055/s-0029-1218742
3.Swain, C. G.; Rogers, R. J. (1975). "Mechanism of formation of aryl fluorides from arenediazonium fluoborates". J. Am. Chem. Soc. 97 (4): 799–800. https://doi.org/10.1021/ja00837a019
4.Singh, R. P. , Shreeve, J. M.. 2004. For a review of recent highlights: Acc. Chem. Res..37, 31.
5.Eldrup AB, Prhavc M, Brooks J, Bhat B, Prakash TP, Song Q, Bera S, Bhat N, Dande P, Cook PD, et al. 2004. Structure?Activity Relationship of Heterobase-Modified 2’-C-Methyl Ribonucleosides as Inhibitors of Hepatitis C Virus RNA Replication. J. Med. Chem.. 47(21):5284-5297.
https://doi.org/10.1021/jm040068f

